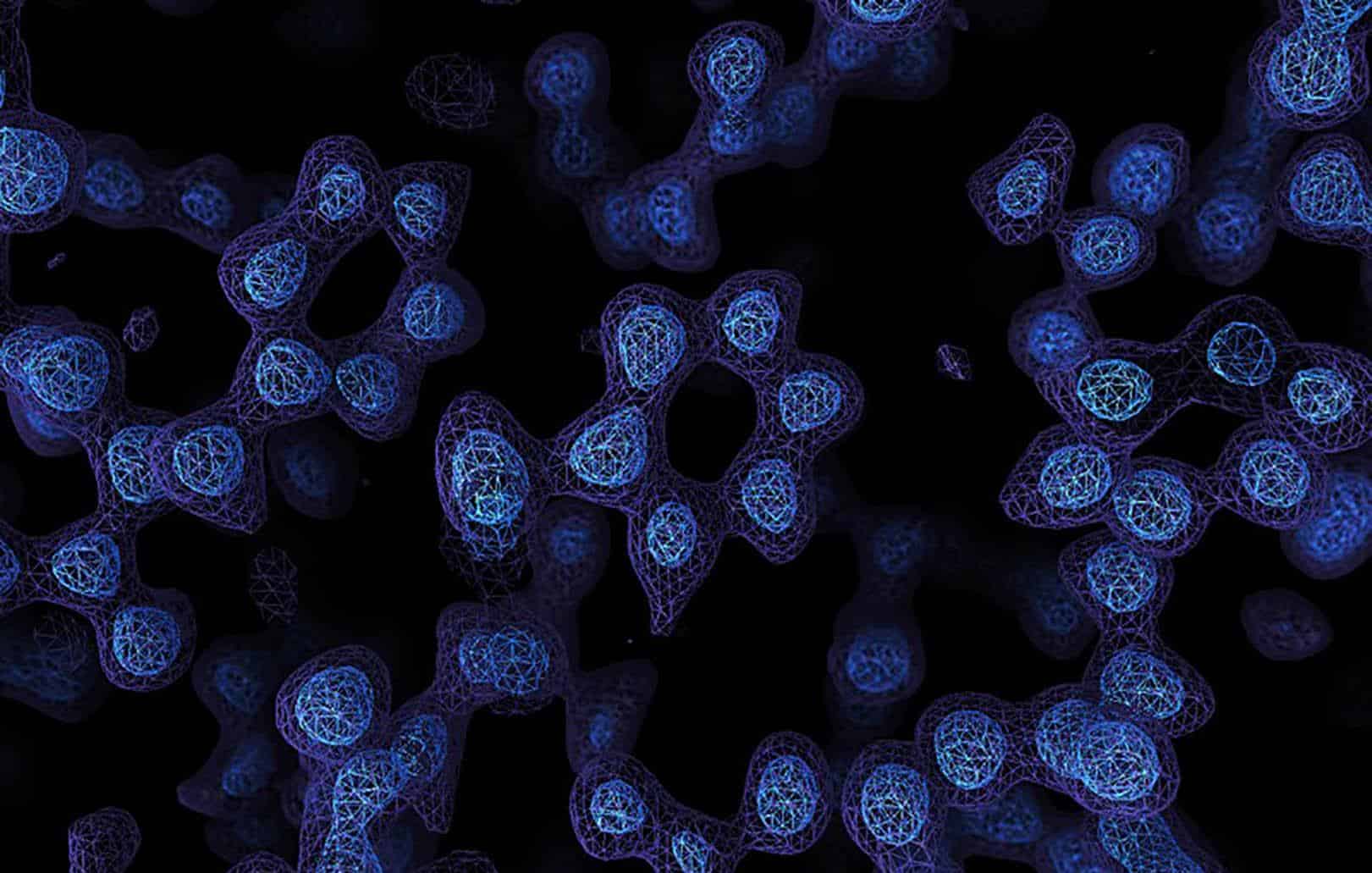
Pesquisadores conseguiram discernir átomos individuais em uma proteína usando uma técnica conhecida como crio-microscopia eletrônica (crio-ME). Ao atingir a resolução atômica, os cientistas serão capazes de entender, em detalhes sem precedentes, o funcionamento de proteínas que não podem ser facilmente examinadas por outras técnicas de imagem.
“É realmente um marco, com certeza. Não há realmente mais nada para quebrar: essa foi a última barreira de resolução”, afirma o bioquímico Holger Stark, do Instituto Max Planck de Química Biofísica em Göttingen, Alemanha, que liderou um dos estudos sobre a crio-ME.
O outro estudo foi liderado por Sjors Scheres e Radu Aricescu, biólogos estruturais do Laboratório de Biologia Molecular do Conselho de Pesquisa Médica de Cambridge, no Reino Unido. As duas pesquisas foram publicadas no servidor de pré-impressão bioRxiv.
A crio-EM usa um congelamento instantâneo da amostra sem cristalizar proteína, mantendo-a hidratada e disparando um feixe de elétrons contra ela – gravando as imagens resultantes. Apesar de não ser uma novidade em si, os avanços na tecnologia de detecção de elétrons catalisaram uma “revolução de resolução” desde 2013, que vêm colocando a técnica com a ideal para mapear as formas 3D das proteínas.
Os mapas de resolução atômica são precisos o suficiente para discernir inequivocamente a posição de átomos individuais de uma proteína, com uma resolução de cerca de 1,2 ångströms (0,000000012 milímetros). Pesquisas nessa escala são especialmente úteis para entender como as enzimas funcionam e usar essas informações para identificar medicamentos que podem bloquear sua atividade.
A imagem revelou detalhes nunca vistos na proteína – incluindo as moléculas de água no bolso onde fica um produto químico chamado histamina. “Essa é uma mina de ouro para o design de medicamentos”, explica Aricescu, “porque mostra como um medicamento pode deslocar as moléculas de água, resultando potencialmente em medicamentos com menos efeitos colaterais”.
Via: Nature